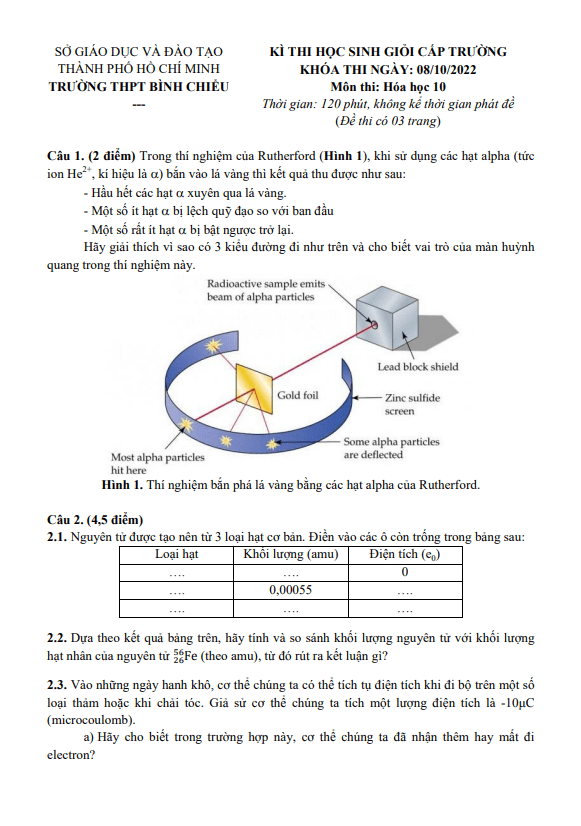
THI247.com sưu tầm và giới thiệu đến bạn đọc nội dung đề thi và bảng đáp án / hướng dẫn giải Đề học sinh giỏi Hóa học 10 năm 2022 – 2023 trường THPT Phùng Khắc Khoan – Hà Nội.
Câu 1: (3 điểm) a) Cho các nguyên tố Sulfur (S) (Z=16); Iron (Fe) (Z=26); Chromium (Cr) (Z=24); Copper (Cu) (Z=29). Viết cấu hình electron nguyên tử và ion của S, Fe, Cr, Cu, S2- Fe2+, Fe3+ Cr3+ Cu2+? Biểu diễn cấu hình electron theo ô orbital của S, Fe, Cr, Cu. b) X, Y, R, A, B, M theo thứ tự là 6 nguyên tố liên tiếp trong Hệ thống tuần hoàn có tổng số đơn vị điện tích hạt nhân là 63 (X có số đơn vị điện tích hạt nhân nhỏ nhất). – Xác định số đơn vị điện tích hạt nhân của X, Y, R, A, B, M. – So sánh bán kính của X2−, Y− R, A+ B2+, M3+ và giải thích? Câu 2: (3 điểm) a) Bán kính nguyên tử và khối lượng mol nguyên tử của iron (Fe) lần lượt là 1,28 o A và 56 g/mol.
Biết rằng trong tinh thể, các nguyên tử Fe chỉ chiếm 74% thể tích, còn lại là khe trống. Tính khối lượng riêng của nguyên tử Fe. b) Trong thể dục thể thao, có một số vận động viên sử dụng các loại chất kích thích trong thi đấu, gọi là doping, dẫn đến thành tích đạt được của họ không thật so với năng lực vốn có. Một trong các loại doping thường gặp nhất là testosterone tổng hợp. Tỉ lệ giữa hai đồng vị 12 6C (98,98%) và 13 6C (1,11%) là không đổi đối với testosterone tự nhiên trong cơ thể. Trong khi testosterone tổng hợp (tức doping) có phần trăm số nguyên tử đồng vị 13 6C ít hơn testosterone tự nhiên. Đây chính là mấu chốt của xét nghiệm CIR (Carbon Isotope Ratio.
Tỉ lệ đồng vị carbon) – một xét nghiệm với mục đích xác định xem vận động viên có sử dụng doping hay không. Giả sử, thực hiện phân tích CIR đối với một vận động viên thu được kết quả phần trăm số nguyên tử đồng vị 12 6C là x và 13 6C là y. Từ tỉ lệ đó, người ta tính được nguyên tử khối trung bình của carbon trong mẫu phân tích có giá trị là 12,0098. Với kết quả thu được, em có nghi ngờ vận động viên này sử dụng doping không? Vì sao? Câu 3: (3 điểm) a) Nguyên tố A là thành phần thiết yếu cho mọi sự sống. D là nguyên tố rất quan trọng trong nhiều ngành công nghiệp đồ gốm, men sứ, thuỷ tinh, vật liệu bản dẫn, vật liệu y tế, …. Oxide ứng với hóa trị cao nhất của hai nguyên tố A và D đều có dạng RO2. Hợp chất khí với hydrogen của A chứa 25 % hydrogen về khối lượng, còn hợp chất khí với hydrogen của D chứa 87,5 % D về khối lượng.
Viết công thức hợp chất khí với hydrogen của các nguyên tố A và D. – Viết công thức oxide ứng với hoá trị cao nhất của A, D và hydroxide tương úng. So sánh tính acid – base giữa các oxide, hydroxide đó. Giải thích. b) Phosphine là hợp chất hóa học giữa phosphorus với hydrogen, có công thức hóa học là PH3. Đây là chất khí không màu có mùi tỏi, rất độc, không bền tự cháy trong không khí ở nhiệt độ thường và tạo thành khối phát sáng bay lơ lửng. Phosphine sinh ra khi phân hủy xác động, thực vật và thường xuất hiện trong thời tiết mưa phùn (hiện tượng “ma trơi”). Vận dụng quy tắc octet để giải thích sự tạo thành liên kết hóa học trong phosphine.
[ads]